Etapa do Boi Verde chega a Tocantins
17 de março de 2005MS: leilão de Bumlai faturou R$ 2,4 milhões
21 de março de 2005Microrganismo geneticamente modificado controlador de leveduras na prevenção da deterioração aeróbica de silagens de milho
por Lucas José Mari1 e Luiz Gustavo Nussio2
1. INTRODUÇÃO
A exposição da silagem ao oxigênio (O2) durante a estocagem ou o fornecimento para os animais, seja no cocho ou mesmo no painel do silo leva a mudanças em sua constituição devido à degradação do ácido lático, atribuídas, principalmente, às leveduras utilizadoras de ácido lático como as do gênero Pichia e Cândida. As conseqüências dessa ação se traduzem no aumento do pH e altas perdas de nutrientes e de matéria seca (MS). Para o controle de leveduras a utilização de ácido propiônico exige doses elevadas, tornando-se relativamente onerosas. Além de caracterizar-se pela ação corrosiva, o ácido propiônico pode acarretar em queda no consumo voluntário do animal, além de sua ação ser específica para cada gênero de levedura (Kung Junior et al., 1998; McDonald et al., 1991).
Através da investigação de cepas de microrganismos que controlassem levedura do gênero Saccharomyces em bebidas alcoólicas japonesas do tipo saquê (Ouchi & Akiyama, 1976) e em vinhos (Hara et al., 1980; Ramon-Portugal et al., 1998), os pesquisadores Kitamoto e seus colaboradores (1999) postularam que essas mesmas cepas poderiam ser eficientes em prolongar a estabilidade aeróbica de silagens.
2. MICRORGANISMOS CONTROLADORES DE LEVEDURAS
Os microrganismos controladores de leveduras possuem proteínas que são letais para certas espécies de leveduras e vários microrganismos foram reportados como ativos para limitar e/ou extinguir leveduras (Young & Yagiu, 1978). Num trabalho anterior, Kitamoto et al. (1993) selecionaram uma cepa de leveduras, conhecida como Kluyveromyces lactis IFO1267, na qual observaram amplo espectro de atuação para controle de leveduras que atuam em aerobiose. Foram efetivas no controle aeróbico do crescimento de Saccharomyces cerevisae. Entretanto, os autores concluíram que essa levedura controladora também utiliza o ácido lático. Então, para que não tenha habilidade de crescer em meio lático, seria necessária uma mutagênese através da ruptura do gene fosfoenolpirutato-carboquinase (KlPCKl). Duas variedades de leveduras foram utilizadas, K. lactis IFO1267 (KlPCKl) e K. lactis PCK27 (klpckl). Além disso, outra variedade oriunda da radiação ultravioleta (UV) da K. lactis IFO1267, também foi utilizada, originando a variedade K. lactis m8. Como modelos de fermentação da silagem de milho (Zea mays L.), o alvo (levedura) e a bactéria lática foram respectivamente, Pichia anômala AHU3936, 3937 e 3938 e Lactobacillus plantarum MAFF516001.
3. MATERIAL E MÉTODOS
Foram utilizados sacos plásticos de polietileno como silos laboratoriais. Para garantir o ambiente anaeróbico durante a fermentação foi utilizada uma bomba de vácuo e, após a retirada do ar, os silos foram vedados. A condição aeróbica foi estabelecida após a abertura dos silos.
Culturas de leveduras foram preparadas em meio de peptona e dextrose e a cultura de L. plantarum em meio de glicose, peptona e extrato de levedura. A bactéria L. platarum foi inoculada (106 UFC g-1) em forragens de milho com 30% de MS, estéril (em gás de óxido de etileno, 37 ºC, por 3 h) e com adição de 1% de lactose.
Dependendo do objetivo experimental as variedades controladoras de leveduras (106 UFC g-1) e as variedades alvo (102 UFC g-1) foram inoculadas separadamente ou combinadas. Os silos experimentais foram mantidos no mesmo ambiente, garantindo condições semelhantes, em 28 ºC, por três semanas, sob condições anaeróbicas e, então, por dois, cinco e oito dias após a abertura, em condições aeróbicas.
A contagem de unidades formadoras de colônia (UFC) ocorreu sendo utilizado meio específico para cada espécie. A contagem total de leveduras (assimiladoras de glicose, assimiladoras de ácido lático e assimiladoras de lactose) ocorreu em placas de Petri com ágar (nitrogênio), enquanto que para a contagem de P. anômala foi com ágar baseado em carbono. K. lactis foi distinguida das demais colônias por sua coloração rosada.
Todos dados foram analisados pelo procedimento GLM do SAS (1996), sendo utilizado o teste de Duncan e P < 0,05 foi considerado significante. 4. RESULTADOS
4.1. Comparação entre variedades mutagênica (PEPCK) e típica (IFO1267) de K. lactis
O crescimento foi similar até o 5o dia após a abertura, quando o teor total de açúcares decresceu em 0,02%. Entre o 5o e o 8o dia o crescimento da levedura PEPCK decresceu, enquanto, a IFO1267 aumentou significativamente. Nessas condições o teor de ácido lático e o pH da PEPCK não se alteraram. Em contraste, significante declínio do ácido lático e aumento do pH foi observado nas silagens inoculadas com PEPCK. Isso indica que a levedura K. lactis não apresentou crescimento durante a fase de aerobiose, sem, assim, utilizar o ácido lático como fonte de carbono.
4.2. Efeito controlador em diferentes leveduras-alvo no modelo de fermentação de silagem
O efeito controlador da levedura K. lactis PCK27 sobre o desenvolvimento da P. anômala AHU3936, 3937 e 3938 foi estuda nesse experimento. P. anômala tem, segundo Jonsson & Pahlow (1984), uma grande habilidade fermentativa e alta capacidade de respiração de ácidos orgânicos, além de possuir papel importante na deterioração aeróbica de silagens. Tanto aeróbica quanto anaerobicamente a adição de controladores de leveduras diminuiu significativamente o crescimento das leveduras-alvo (Gráfico 1).
Gráfico 1 – Curva de crescimento de P. anômala em combinações de variedades de K. lactis em silagens de milho.
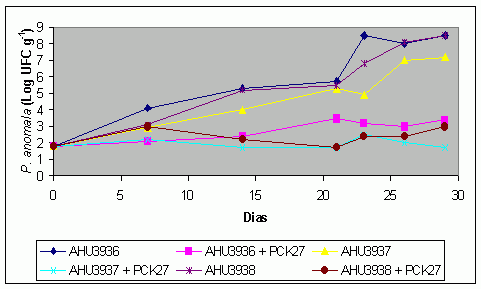
Após a abertura dos silos, aumentos significativos no valor de pH e decréscimos nos teores de açúcares residuais foram observados apenas nas silagens sem a inoculação dos controladores de leveduras. Sob essas condições, os níveis de ácido láticos apresentaram tendência (P = 0,06) de se diferenciar entre as silagens tratadas ou não com controladores de leveduras. A curva de crescimento dos microrganismos controladores de leveduras foi praticamente a mesma em todos tratamentos, indicando a inibição da levedura-alvo P. anômala. Conseqüentemente, a degradação de açúcares e ácido lático e o aumento do pH ocorreram em menor intensidade.
Foi avaliada a produção da proteína controladora, seu efeito na ensilagem e comparada a diferença do crescimento de P. anômala AHU3936 entre os tratamentos inoculados com K. lactis PCK27 ou IFO1267 conjuntamente com a variedade K. lactis m8 (Gráfico 2).
Gráfico 2 – Curva de crescimento de P. anômala em combinações de variedades de K. lactis em silagens de milho.
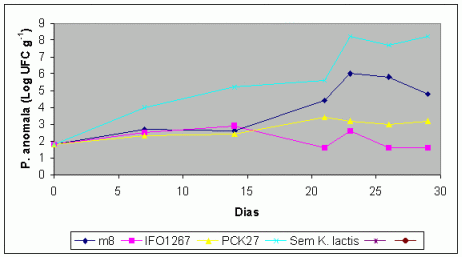
O crescimento de P. anômala AHU3936 foi marcadamente limitado pela adição de qualquer variedade K. lactis tanto sob aerobiose quanto em anaerobiose. Após a abertura, o crescimento de P. anômala mostrou que as variedades controladoras modificadas de leveduras foram menos efetivas que as variedades típicas. Quanto às leveduras-alvo, não foram observadas diferenças entre as variedades modificadas ou típicas. O crescimento de todas variedades K. lactis foi similar. Além disso, a inibição não foi somente devida à competição no crescimento como também conseqüência da proteína produzida pelos microrganismos modificadores.
4.4. Efeito da adição de controladores de leveduras sobre a silagem de milho
Finalmente, foi avaliado o efeito de ambas variedades controladoras de leveduras em silos laboratórios de silagem de milho adicionada de 1% de lactose. As duas variedades de K. lactis, PCK27 e IFO1267 mostraram-se similares no crescimento após três dias em anaerobiose. Além disso, essas variedades falharam na produção de colônias em meio seletivo para tal função, mesmo após 14 dias de incubação em anaerobiose. Em vista disso, não foi possível a completa comparação entre as duas variedades controladoras. Entretanto, ambas apresentaram aumento significativo na estabilidade aeróbica se comparadas às silagens controle.
Na Gráfico 3, pode-se observar a curva de crescimento de leveduras assimiladoras de ácido lático. A população de leveduras assimiladoras de ácido lático aumentou significativamente durante o período anaeróbico nos tratamentos que continham controladores de leveduras, todavia, não foi observada diferença na população de leveduras entre a 1a e 3a semanas de anaerobiose.
Gráfico 3 – Curva de crescimento de leveduras assimiladoras de ácido lático excluindo-se K. lactis de silagens de milho adicionadas de microrganismos controladores de leveduras.
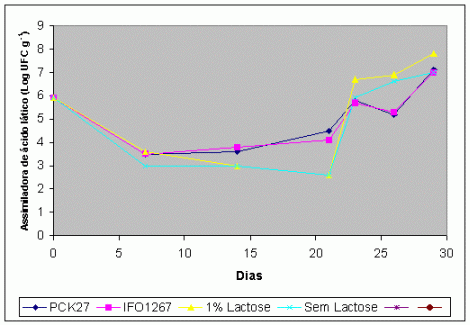
Em condições anaeróbicas, a porcentagem de leveduras, relacionadas àquelas assimiladoras de ácido lático, foi mais elevada nas silagens que foram inoculadas com controladores de leveduras que nas silagens controle. Entretanto, sob condições aeróbicas o comportamento foi exatamente oposto. Em aerobiose, leveduras que não assimilavam ácido lático compuseram o maior percentual populacional de leveduras totais nas silagens inoculadas com microrganismos controladores. Através desses dados pode-se concluir que a inoculação com controladores de leveduras é capaz de alterar a flora epifítica, possivelmente, afetando os resultados finais. Os valores de pH (Gráfico 4) das silagens controle elevaram-se significativamente de 3,7 até 6,0 dos dias 5o ao 8o, para as silagens com ou sem a adição de lactose, respectivamente. As silagens inoculadas com controladores de leveduras tiveram seu pH estável até o 5o dia e este se elevou para 4,5 no 8o dia.
Gráfico 4 – Variação temporal do pH de silagens de milho adicionadas de microrganismos controladores de leveduras.
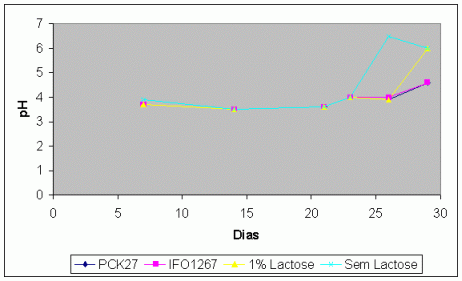
A adição de variedades que controlam K. lactis conjuntamente com lactose retardou a deterioração aeróbica das silagens de milho.
5. CONCLUSÕES
Variedades de K. lactis que controlam leveduras, podem não evitar a deterioração aeróbica de silagens, pois muitos outros fatores em conjunto são responsáveis por tal ação, como outros microrganismos, condições químicas e físicas da forragem e do meio, dentre outros. Outros estudos contendo esses microrganismos são necessários, sobretudo para elucidar o papel das proteínas moduladoras de crescimento de leveduras. São necessários também estudos que combinem alguns microrganismos controladores de leveduras, que produzam proteínas que controlem leveduras e sejam capazes de não causarem danos ao ambiente após desenvolverem suas funções.
REFERÊNCIAS BIBLIOGRÁFICAS
HARA, S.; IIMURA, Y.; OTSUKA, K. Breeding of useful killer wine yeasts. American Journal of Enology and Viticulture, v.31, p.28-33, 1980.
JONSSON, A.; PAHLOW, G. Systematic classification and biochemical characterization of yeasts growing in grass silage inoculated with Lactobacillus cultures. Animal Research and Development, v.20, p.7-22, 1984.
KITAMOTO, H.K.; OHMOMO, S.; NAKAHARA, T. Selection of killer yeasts (Kluyveromyces lactis) to prevent aerobic deterioration in silage making. Journal of Dairy Science, v.76, p.803-811, 1993.
KITAMOTO, H.K.; HASEBE, A.; OHMOMO, S.; SUTO, E.G.; MURAKI, M.; IIMURA, Y. Prevention of aerobic spoilage of maize silage by genetically modified killer yeast, Kluyveromyces lactis, defective in the ability to grow on lactic acid. Applied Environmental Microbiology, v.65, n. 10, p.4697-4700, 1999.
KUNG JUNIOR, L.; SHEPERD, A.C.; SMAGALA, A.M.; ENDRES, K.M.; BESSETT C.A.; RANJIT, N.K.; GLANCEY, J.L. The effect of preservatives based on propionic acid on the fermentation and aerobic stability of corn silage and total mixed ration. Journal of Dairy Science, v.81, p.1322-1330, 1998.
McDONALD, P.J.; HENDERSON, A.R.; HERON, S.J.E. The biochemistry of silage. 2.ed. Mallow: Chalcombe Publications, 1991. 340p.
OUCHI, K.; AKIYAMA, H. Breeding of useful killer sake yeasts by repeated back-crossing. Journal of Fermentation Technology, v.54, p.615-623, 1976.
RAMON-PORTUGAL, F.; DELIA, M.L.; STREHAIANO, P.; RIBA, J.P. Mixed culture of killer and sensitive Saccharomyces cerevisiae strains in batch and continuous fermentations. World Journal of Microbiology & Biotechnology, v.14, p.83-87, 1998.
SAS. SAS user´s guide: version 6.12. Statistical Analysis System Institute, Inc., Cary, N.C., 1996.
YOUNG, T.W.; YAGIU, M. A comparison of the killer character in different yeasts and its classification. Antonie Van Leeuwenhoek, v.44, p.59-77, 1978.
______________________________________________________________
1 Médico Veterinário, Mestre, Doutorando em “Ciência Animal e Pastagens” – USP/ESALQ.
2 Professor Associado do Departamento de Zootecnia – USP/ESALQ – Piracicaba, SP.

