Reino Unido: aumento dos abates, queda do consumo
24 de agosto de 2005Futuro do agronegócio passa pelo marketing
26 de agosto de 2005Ferro, zinco, carne bovina e cognição: parte 1
Introdução
A ingestão de quantidades inadequadas de proteína e energia, denominada de síndrome de múltiplas deficiências nutricionais, compromete o desenvolvimento cognitivo de crianças e sua capacidade de aprender. Mesmo déficits nutricionais de curto prazo, como passar fome ou pular uma refeição, como o café da manhã, pode contribuir para uma performance acadêmica alterada. Da mesma forma que em adultos, a subnutrição resultante da ingestão inadequada de alimentos pode contribuir para déficits cognitivos e prejudicar sua capacidade de viver de forma independente.
Descobertas de estudos com animais experimentais e humanos indicam que as deficiências de ferro e zinco podem afetar a cognição. Estudos com animais experimentais indicam que o ferro e o zinco são componentes essenciais do cérebro e estão envolvidos no desenvolvimento do cérebro e das funções do sistema nervoso central, incluindo a produção e o catabolismo de neurotransmissores. Em humanos, a deficiência de ferro contribui para falhas cognitivas incluindo menor performance neuropsicológica em bebês, crianças em idade pré-escolar e em idade escolar, adolescentes e adultos. Algumas descobertas de pesquisas indicam que a deficiência precoce de ferro (isto é, na infância) pode causar conseqüências neuropsicológicas irreversíveis. Entretanto, o fornecimento adequado na pré-escola e em crianças mais velhas parece melhorar a performance cognitiva.
Comparado com o ferro, existem menos estudos que avaliaram o papel do zinco na performance neuropsicológica em humanos. Um estudo recente mostrou que o fornecimento adequado de zinco melhorou alguns índices de desempenho neuropsicológico em crianças com idade escolar quando outros micronutrientes limitantes também foram fornecidos de forma adequada.
As pessoas consomem alimentos, e não nutrientes em si. Desta forma, os efeitos da carne vermelha, uma excelente fonte de ferro e zinco, na performance neuropsicológica é de interesse prático. Alguns estudos animais indicam que o fornecimento adequado de ferro e zinco usando carne bovina corrige os déficits cognitivos. Não foram feitos estudos similares com humanos.
Dados sobre a ingestão de alimentos nos Estados Unidos indicam que muitos segmentos da população norte-americana têm baixas ingestões de ferro e zinco. Quando se considera as escolhas de alimentos pelas pessoas e a disponibilidade de alimentos ricos em ferro e zinco biodisponíveis, as deficiências desses nutrientes podem ser mais comuns do que é reconhecido pela maioria dos profissionais de saúde. As atuais recomendações para que os norte-americanos saudáveis consumam de duas a três porções por dia de alimentos do Grupo Carnes pode suprir as necessidades nutricionais de ferro e zinco se as carnes vermelhas forem escolhidas.
Nutrição e função cognitiva
Muitos fatores influenciam a função cognitiva ou a capacidade de perceber, pensar e lembrar das pessoas. A nutrição é provavelmente o fator mais importante que afeta a expressão da cognição geneticamente determinada (1,2). O reconhecimento da associação positiva entre nutrição e cognição, particularmente no desempenho escolhas, foi um dos motivos fundamentais para o desenvolvimento de programas governamentais de nutrição infantil nos EUA como os programas de lanche escolar ou os de café da manhã. Para adultos mais velhos, a nutrição adequada pode ajudar a reverter ou impedir os déficits cognitivos relacionados à idade. Falhas no funcionamento cognitivo, evidenciadas por déficits na memória, resolução de problemas, orientação ou abstração, podem reduzir a capacidade de adultos mais velhos de agir independentemente (3).
A inadequada ingestão de proteína e energia, ou seja, síndrome de múltiplas deficiências nutricionais, está associada com uma variedade de déficits cognitivos e comportamentais (1,4,5). A subnutrição severa reduz a interação da criança com o meio-ambiente o que, por sua vez, pode levar a problemas de atenção, memória de curto prazo e fraco desempenho escolar. É de particular interesse constatar se a nutrição, especialmente em períodos críticos de crescimento ou amadurecimento cerebral, tem efeitos de longa duração no funcionamento cognitivo mais para frente. Para responder esta questão, foi fornecido um suplemento com alto nível de energia para 334 bebês e crianças até dois anos da Indonésia que participaram de um estudo aleatório de três meses feito em 1986 e 1987 (6). Oito anos depois a função de memória foi medida em 231 crianças, 125 delas tendo recebido o suplemento anteriormente e 106 controles da mesma comunidade (6). O suplemento nutricional teve efeitos benéficos de longa duração na memória, mas somente nas crianças que o receberam no começo de suas vidas (isto é, antes dos 18 meses de idade).
Apesar de terem sido feitos muitos estudos, ainda precisam ser estudadas muitas coisas sobre o impacto da nutrição no desempenho cognitivo de adultos (1,4). Considerando o número crescente de adultos mais velhos, o entendimento de fatores que contribuem para a manutenção da performance cognitiva é uma questão de alta prioridade (7). Mesmo a desnutrição de curto prazo ou a fome é associada negativamente com o desenvolvimento cognitivo (8-13). A fome limita a capacidade da criança de aprender, em parte por reduzir sua capacidade de responder ao ambiente, de prestar atenção e de obter informações (14). Crianças de famílias que apresentaram experiências freqüentes com insuficiência alimentar e fome apresentaram problemas comportamentais, acadêmicos e emocionais com maior freqüência do que as crianças de famílias com renda similar mas que não passaram por episódios de fome (15).
Déficits nutricionais em crianças resultantes de pular uma refeição, como o café da manhã, foram associados com um menor desempenho acadêmico. Em contraste, a participação no programa federal de café da manhã dos EUA mostrou uma melhora na performance cognitiva (8,10-12,16,17).
Para entender como a subnutrição, a fome e até o fato de pular uma refeição pode ter um papel na cognição, é importante fazer considerações sobre a qualidade da deita e de nutrientes específicos. Existem poucas pesquisas sobre os efeitos dos produtos de origem animal, como carnes vermelhas, na cognição (18). Como revisado abaixo, o papel do ferro na dieta na função cognitiva foi estudado em animais experimentais e em humanos (5,19,20). Deficiências de ferro e zinco podem estar envolvidas em muitos dos mesmos efeitos atribuídos à subnutrição de proteína e energia (19,21). Considerando que as carnes vermelhas, como a carne bovina, são as principais fontes de ferro e zinco biodisponíveis da dieta, a suposição lógica é que o consumo regular deste alimento melhora a performance neuropsicológica.
Papel do ferro no desenvolvimento e na função cognitiva
a) Deficiência de ferro é um problema nutricional prevalente
Apesar de a deficiência de ferro ter declinado substancialmente nas últimas décadas, esta continua sendo a desordem nutricional mais prevalente no mundo todo, afetando mais de dois bilhões de pessoas ou mais de um terço da população mundial (22). Bebês, crianças na puberdade e mulheres em idade reprodutiva fazem parte do grupo de maior risco de deficiência de ferro (23,24). Nos EUA, a deficiência de ferro ocorre em 9% das crianças com idade de 12 a 35 meses, menos de 1% em crianças com mais de três anos de idade e de 9% a 11% em meninas adolescentes e mulheres com idade de 12 a 49 anos (23,25). A anemia por deficiência de ferro, a forma mais severa de deficiência deste elemento, afeta 3% das crianças dos EUA com idade de 12 a 35 meses e de 3% a 5% das adolescentes e mulheres (23,25). Apesar de a prevalência de anemia por deficiência de ferro ser relativamente baixa nos EUA comparado com aquela nos países menos desenvolvidos, a carência de estoques de ferro e as conseqüências fisiológicas da deficiência de ferro não são incomuns em alguns grupos da população, com mulheres na pré-menopausa (26).
Cerca de 1/3 da população mundial é afetada por deficiência de micronutrientes. Estima-se que 94 milhões de pessoas sofram de deficiência de ferro ou anemia ferropriva, nas Américas. No Brasil a prevalência da anemia é de 20% em adolescentes, de 15 a 30% em gestantes e de até 50% em crianças de 6 a 60 meses (Ministério da Saúde) (100).
O Brasil aparece na listagem com deficiências significativas de ferro em crianças com menos de 5 anos (45%) e em mulheres de 15 a 49 anos (21%) e 880 mortes por ano em decorrência de anemia severa, de acordo com pesquisa realizada pelo Fundo das Nações Unidas para a Infância (Unicef) e pela Iniciativa por Micronutrientes (MI, na sigla em inglês) (101).
Crianças com rápida taxa de crescimento que ingerem baixa quantidade de ferro na dieta, particularmente durante os primeiros dois anos de vida, têm um risco aumentado de desenvolver deficiência de ferro (23). Dados da Pesquisa Contínua de Ingestão de Alimentos por Indivíduos (Continuing Survey of Food Intakes by Individuals – CSFII), do Departamento de Agricultura dos Estados Unidos (USDA), de 1994-96 (27), indicam que mais da metade das crianças de um a dois anos de idade não ingerem a quantidade diária recomendada (25) de ferro em sua dieta (Tabela 1). Depois dos dois anos de idade, o risco de deficiência de ferro na infância diminui como resultado de um crescimento mais lento e uma dieta mais diversificada. Para adolescentes do sexo feminino e mulheres adultas, os riscos de anemia por deficiência de ferro aumentam por: uma dieta pobre em ferro, baixa absorção da maioria do ferro dietético, presença de outros fatores dietéticos que inibem a absorção de ferro, menstruação e condições médicas que afetam o status de ferro (22,23). Quando a ingestão de nutrientes em mulheres jovens de 18 a 24 anos de idade que participaram da Segunda Pesquisa Nacional de Análise de Saúde e Nutrição (National Health and Nutrition Examination Survey – NHANES II) foram examinadas, a ingestão de ferro pelos alimentos (10,7 mg/dia) era bem abaixo da quantidade diária recomendada, de 18 mg de ferro/dia (29).
Tabela 1. Ingestões diárias de ferro e zinco com base nos dados da CSFII USDA, 1994-96
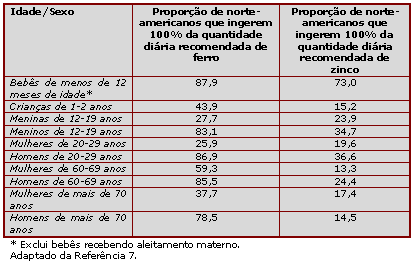
b) Como o ferro influencia a cognição?
A deficiência de ferro, em particular a anemia por deficiência de ferro, pode afetar a função cognitiva diretamente e/ou indiretamente (30,32). Diretamente, a deficiência de ferro leva a um menor nível cerebral de ferro o que, por sua vez, prejudica a mielinização das células nervosas e neurotransmissores, particularmente da dopamina (Figura 1). Essas mudanças podem contribuir para alterações na maturação e na função de uma variedade de aspectos do sistema nervoso central. Indiretamente, a deficiência de ferro pode ter um impacto no comportamento cognitivo reduzindo a atenção e a resposta ao ambiente. Isso, por sua vez, pode levar a menos experiências de aprendizagem e menor habilidade de adquirir informações.
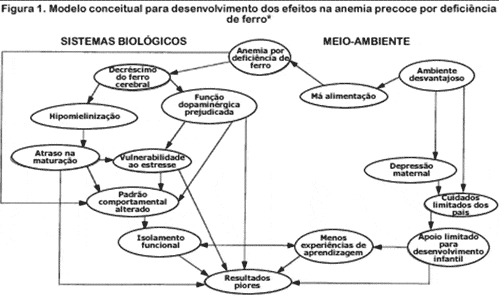
*O lado direito do modelo mantém o foco nas influências ambientais na criança e o lado esquerdo começa com as influências biológicas. Tanto os mecanismos ambientais como os biológicos produzem resultados piores.
Da referência 32.
c) Estudos com animais experimentais fornecem visões sobre o papel do ferro na cognição
Descobertas a partir de animais experimentais fornecem suporte para o papel essencial do ferro no desenvolvimento cognitivo e revelam mecanismos pelos quais o ferro influencia na cognição. Ratos alimentados com uma dieta deficiente em ferro desde o nascimento com menores níveis de heme ferro apresentaram menores respostas a estímulos ambientais e exibiram déficits de aprendizagem comparado com os animais que receberam quantidade adequada de ferro (33-36). Além disso, o decréscimo no ferro cerebral e os déficits de aprendizagem persistiram, apesar da aumentada ingestão de ferro (35). Modelos animais indicam que a deficiência precoce de ferro reduz os estoques de ferro do cérebro o que prejudica a atividade de enzimas ferro-dependentes necessárias para síntese, função e degradação de neurotransmissores como dopamina (36). Essas descobertas feitas com animais de laboratório fornecem algumas informações sobre os efeitos da deficiência de ferro em bebês humanos (32). Tanto cérebros de ratos como de humanos são vulneráveis a fatores nutricionais e outros fatores ambientais durante o desenvolvimento neurológico e o ferro é distribuído em regiões similares do cérebro em ambas as espécies (32).
d) Estudos com humanos dão suporte ao papel essencial do ferro na cognição
Estudos com humanos fornecem evidências de que a ingestão adequada de ferro durante a vida, da infância até o final da vida adulta, é importante para que se obtenha todo o potencial cognitivo do indivíduo. A maioria das pesquisas com humanos sobre os efeitos cognitivos do ferro tem seu foco em bebês, crianças em idade pré-escolar e crianças com idade escolar (30). Existem consideravelmente menos informações sobre adultos.
Bebês e crianças até dois anos de idade
Devido às mudanças neurais mais complexas no cérebro humano após o nascimento que ocorrem durante os primeiros dois anos de vida, o desenvolvimento cognitivo do bebê é considerado como particularmente vulnerável à deficiência de ferro (30,32). A maioria dos estudos sobre ferro e cognição em bebês e crianças até dois anos de idade usa testes padronizados sobre o desenvolvimento de bebês, Escala Bayley de Desenvolvimento Infantil. Este teste tem três componentes: índice de desenvolvimento mental, índice de desenvolvimento motor e registro do comportamento infantil (30). Bebês e crianças até dois anos com anemia por deficiência de ferro geralmente apresentam um desempenho pior nos testes de desenvolvimento mental e motor (30,31,37-42). Além disso, esses bebês e crianças são descritos como sendo mais retraídos, cautelosos, indecisos e mantêm uma maior proximidade física com suas mães do que as crianças sem deficiência de ferro (32,41). Esses tipos de comportamento podem interferir com a capacidade do bebê ou da criança de interagir com o meio-ambiente o que, por sua vez, pode comprometer seu desenvolvimento intelectual.
Apesar de a deficiência de ferro estar associada com função cognitiva prejudicada em bebês e crianças, uma relação causa ainda precisa ser conclusivamente estabelecida. Como revisado por Abbott (31), tanto estudos de intervenção de ferro de curto prazo como os de longo prazo indicaram pouco ou inconsistentes melhoras na função mental e cognitiva de bebês. Essas descobertas podem ser explicadas pelas diferenças na duração e extensão da deficiência de ferro, pelo projeto dos estudos e pela presença de fatores perturbadores, como outras deficiências nutricionais (43). De forma geral, menores resultados no desenvolvimento mental foram observados em bebês com anemia por deficiência de ferro do que naqueles com deficiência de ferro sem anemia, indicando um efeito da severidade da deficiência de ferro (39).
O mais forte suporte para a ligação causal entre deficiência de ferro e desenvolvimento cognitivo nos primeiros anos de vida veio de um estudo controlado, aleatório, duplo cego, com 126 crianças de 12 a 18 meses de idade (37). As crianças foram agrupadas de acordo com seu status de ferro e dentro de cada grupo foram aleatoriamente separadas para receber ou 3 mg de sulfato ferroso por quilo ao dia ou um placebo, durante quatro meses. Antes do tratamento, a classificação de desenvolvimento mental das crianças com anemia por deficiência de ferro era significantemente menor do que daquelas com deficiência de ferro, mas sem anemia, e daquelas sem deficiência (Figura 2). A suplementação de ferro melhorou significantemente as classificações de desenvolvimento motor e mental. Além disso, após quatro meses de tratamento, as classificações de desenvolvimento mental nas crianças com suplemento de ferro foram as mesmas daquelas que não tinham deficiência e daquelas com deficiência, mas sem anemia (Figura 2). Este estudo demonstra que o aumento da ingestão de ferro em crianças com deficiência melhora seu desempenho nos testes de desenvolvimento mental e motor a um nível semelhante ao das crianças sem deficiência (37).

Uma importante questão é se os efeitos adversos no desenvolvimento e na função cognitiva da anemia precoce por deficiência de ferro persistem. Alguns estudos indicam que os efeitos no desenvolvimento mental da anemia por deficiência de ferro são reversíveis com um tratamento apropriado de ferro (37,44), enquanto essas descobertas não são apoiadas por outros estudos (32,40,42). Bebês com anemia por deficiência de ferro que apresentaram performance ruim nos testes de avaliação feitos no início da vida mostraram ter menores escores de desenvolvimento mental com idade de cinco anos ou mais do que aqueles que não tiveram a anemia (40). Um estudo de acompanhamento mostrou que crianças que tiveram deficiência de ferro quando bebês continuaram a apresentar piores resultados em testes de leitura, escrita e matemática (isto é, habilidades básicas de conhecimento), bem como nas habilidades motoras gerais 12 anos depois, apesar do status normal de ferro (42). Essas descobertas indicam que a deficiência de ferro na infância tem uma influência negativa de longo prazo na cognição. Entretanto, ainda permanecem questões sobre os efeitos da duração, severidade e/ou cronicidade da deficiência de ferro, bem como da reversibilidade da deficiência de ferro na função cognitiva (45,46).
Crianças em idade pré-escolar (3 a 6 anos)
A anemia por deficiência de ferro entre crianças em idade pré-escolar está associada com um desempenho pior nos testes de QI, testes de aprendizagem e medidas de realização escolar, o que indica processos cognitivos específicos como memória de curto prazo, atenção, discriminação de aprendizado ou tarefas críticas para resolver problemas visuais (30). Comparado com bebês, os benefícios cognitivos do tratamento com ferro parece ser mais aparente em crianças com idade pré-escolar, apesar de as evidências serem limitadas. Uma importante influência da anemia por deficiência de ferro em crianças com idade pré-escolar é a atenção, estímulo e motivação. Além disso, crianças com esta idade com anemia por deficiência de ferro tendem a ser menos alegres e a responder menos a seu ambiente do que as crianças sem deficiência de ferro.
Crianças com idade escolar e adolescentes (a partir de 6 anos)
Similarmente às descobertas de bebês e crianças com idade pré-escolar, a anemia por deficiência de ferro está associada com prejuízo cognitivo em crianças com idade escolar e adolescentes, como pode ser geralmente avaliado pelos testes de cognição ou sucesso escolar (30). Em um estudo caso-controle cruzado feito na Irlanda do Norte envolvendo crianças com idade de 7 a 8 anos, as crianças que apresentaram dificuldades de aprendizado tinham maior probabilidade de ter anemia por deficiência de ferro do que as do grupo controle (47). Um estudo no Egito envolvendo crianças de 8 a 11 anos de idade também mostrou que a anemia por deficiência de ferro afetou de forma adversa o desempenho cognitivo (20). As crianças com anemia por deficiência de ferro fizeram mais erros e foram menos eficientes no “Teste de Combinar Figuras Familiares” do que as não-anêmicas (20). Este estudo demonstrou que as crianças anêmicas tratadas com sulfato ferroso via oral (50 mg ou cerca de 2 mg de ferro elementar) por seus dias consecutivos/semana durante quatro meses reduziram seus erros e melhoraram seus escores de eficiência.
Entre adolescentes, estudos em diferentes regiões do mundo, incluindo Indonésia (48,49), Tailândia (50) e Índia (51), entre outros países (20), mostraram que a anemia por deficiência de ferro está associada com um mau desempenho acadêmico e que a suplementação de ferro (sulfato ferroso) melhora os escores nos testes relacionados com componentes específicos de cognição. Um estudo feito nos EUA, talvez um dos mais importantes estudos dos últimos anos, relacionou a deficiência moderada de ferro, que é comum, com efeitos adversos na cognição (52). Neste estudo clínico duplo-cego, placebo-controlado, 73 adolescentes do sexo feminino não anêmicas, mas com deficiência de ferro foram aleatoriamente divididas para receber sulfato ferroso via oral (650 mg duas vezes ao dia ou 260 mg de ferro elementar diariamente) ou placebo por oito semanas. As funções cognitivas foram medidas por quatro testes de atenção e memória. Comparado com o grupo controle, o grupo que obteve a suplementação de ferro apresentou uma melhora no aprendizado verbal e na memória, ambos importantes para o desempenho acadêmico (52). Este estudo foi o único a mostrar que a deficiência moderada de ferro afeta de forma adversa a função cognitiva e que a suplementação de ferro melhora alguns aspectos da cognição (52). As descobertas acima com crianças em idade escolar e adolescentes contrariam aquelas feitas em estudos com bebês onde os benefícios do tratamento com ferro no desenvolvimento mental foram menos consistentemente observados.
Adultos
Em um estudo cruzado com 69 estudantes universitários saudáveis, a deficiência de ferro foi associada com anormalidades na eletrofisiologia (observada por eletroencefalograma – EEG) do cérebro e cognição anormal (53). Maiores níveis de ferritina sérica foram associadas com maior ativação no hemisfério esquerdo do cérebro do que no direito. O status de ferro foi significantemente relacionado com o desempenho cognitivo em duas de três tarefas cognitivas e essas relações foram consistentes com as assimetrias no EEG. Maior ferritina sérica prevê maior fluência verbal, mas menor desempenho em tarifas auditivas não verbais. Essas descobertas indicam que os estoques de ferro são relevantes para processos neurofisiológicos de sustentação da atenção (53).
Em mulheres adultas, dietas para perda de peso podem reduzir o status de ferro e a capacidade de manter a atenção mesmo com ingestão adequada de ferro, de acordo com um estudo recente (54). Após um período de três semanas, 14 mulheres obesas de 25 a 42 anos consumiram uma dieta com restrição de energia de 50% por 15 semanas e, então, uma dieta para manutenção do peso por três semanas. Durante os períodos de restrição calórica e de manutenção do peso, as mulheres receberam um suplemento fornecendo 100% da quantidade diária recomendada (ou quantidade estimada segura e adequada) de vitaminas e minerais. A ingestão total dietética de ferro durante os períodos de restrição de energia e manutenção do peso chegou a um nível de duas vezes a quantidade recomendada de ferro. Apesar desta ingestão relativamente alta de ferro pela dieta, os status de ferro e hematológico declinaram durante o estudo. Além disso, o declínio no status de ferro (por exemplo, níveis de hemoglobina) foi associado com um decréscimo na capacidade de manter a atenção (54). Pesquisadores sugerem que a incapacidade de manter a atenção pode ser um sinal inicial do desenvolvimento funcional de deficiência de ferro na presença de um status normal deste elemento.
Em adultos mais velhos, a manutenção da performance cognitiva é particularmente importante para sua independência funcional (55). Poucos estudos, entretanto, avaliaram a relação do status de ferro e a cognição neste crescente segmento da população. Em um estudo com 28 adultos saudáveis de mais de 60 anos de idade, três diferentes índices de status de ferro (ferro plasmático, transferrina e ferritina) foram inconsistentemente associados com o desempenho cognitivo (55). Entretanto, a deficiência de ferro foi associada com mudanças sutis em um indicativo do EEG de mudanças neuropatológicas no cérebro de pessoas mais velhas (55). Em outra pesquisa na Espanha envolvendo 260 adultos com idade de 65 a 90 anos, a ingestão dietética de ferro foi positivamente associada com escores em dois testes de função cognitiva (3).
Referências bibliográficas
1. Kretchmer N, Beard JL, Carlson S. The role of nutrition in the development of normal cognition. Am J Clin Nutr. 1996; 63: 997s-1001s.
2. Pollitt E. Poverty and child development: relevance of research in developing countries to the United States. Child Develop. 1994; 65(2): 283-295.
3. Ortega RM, Requejo AM, Andres P, Lopez-Sobalec, AM, Quintas ME, Redondo MR, Navia B, Rivas T. Dietary intake and cognitive function in a group of elderly people. Am J Clin Nutr. 1997; 66: 803-809.
4. Kanarek RB, Marks-Kaufman R. Nutrition and Behavior. 1991. New York: Van Nostrand Reinhold.
5. Wachs TD. Relation of mild-to-moderate malnutrition to human development: correlational studies. J Nutr. 1995: 125: 2245s-2254s.
6. Pollitt E, Watkins WE, Husaini MA. Three-month nutritional supplementation in Indonesian infants and toddlers benefits memory function 8 y later. Am J Clin Nutr. 1997; 66: 1357-1363.
7. LaRue A, Koehler KM, Wayne SJ, Chiulli SJ, Hoaland KY, Garry PJ. Nutritional status and cognitive functioning in a normally aging sample: a 6-y reassessment. Am J Clin Nutr. 1997; 65: 20-29.
8. Pollitt, E., Lewis NS, Garza C, Shulman R. Fasting and cognitive function. J Psychiatr Res. 1982/83; 17: 169-174.
9. Allen, LH. Functional indicators and outcomes of undernutrition. J Nutr. 1990; 120: 924-932.
10. Meyers AF, Sampson AE, Weitzman M, Rogers BL, Kayne H. School breakfast programs and school performance. 1989; 143: 1234-1239.
11. Meyers AF, Sampson AE, Weitzman M. Nutrition and academic performance in school children. Clin Appl Nutr. 1991; 1: 13-25.
12. Simeon DT, Grantham-McGregor S. Effects of missing breakfast on the cognitive functions of school children of differing nutritional status. Am J Clin Nutr. 1989; 49: 646-653.
13. Simeon DT, Grantham-McGregor SM. Nutritional deficiencies and children’s behavior and mental development. Nutr Res Rev. 1990; 3: 1-24.
14. Center on Hunger, Poverty and Nutrition Policy, Tufts University School of Nutrition. Statement on the Link between Nutrition and Cognitive Development in Children. 1995. Medford, MA: Tufts University.
15. Kleinman RE, Murphy M, Little M, Pagano M, Wehler CA, Regal K, Jellinek MS. Hunger in children in the United States: potential behavioral and emotional correlates. Pediatrics 1998; 101: 1-6.
16. Pollitt E. Does breakfast make a difference in school? J Am Diet Assoc. 1995; 95: 1134-1139.
17. Murphy JM, Pagano ME, Nachmani J, Sperling P, Kane S, Kleinman RE. The relationship of school breakfast to psychosocial and academic functioning. Arch Pediatr Adol Med. 1998; 152: 899- 907.
18. Allen LH. The Nutritional CRSP: what is marginal malnutrition, and does it affect human function? Nutr. Rev. 1993; 51: 255-267.
19. Pollitt E. Functional significance of the covariance between protein energy malnutrition and iron deficiency anemia. J Nutr. 1995; 125: 2272s-2277s.
20. Pollitt E. Iron deficiency and educational deficiency. Nutr Rev. 1997; 55: 133-141.
21. Black MM. Zinc deficiency and child development. Am J Clin Nutr. 1998; 68: 464s-469s.
22. Viteri FE. Iron supplementation for the control of iron deficiency in populations at risk. Nutr. Rev. 1997; 55: 195-209.
23. CDC, U.S. Department of Health and Human Services. Recommendations to prevent and control iron deficiency in the United States. MMWR 1998; 46(No.RR-3): 1-29.
24. Looker AC, Dallman PR, Carroll, MD, Gunter EW, Johnson CL. Prevalence of iron deficiency in the United States. JAMA 1997; 277: 973-976.
25. Hallberg L, Rossander-Hulten L. Iron requirements in menstruating women. Am J Clin Nutr. 1991; 54: 1047- 1058.
26. Alaimo K, McDowell MA, Briefel RR et al. Dietary intake of vitamins, minerals, and fiber of persons ages 2 months and over in the United States: Third National Health and Nutrition Examination Survey, Phase 1, 1988-91. Hyattsville, Maryland: National Center for Health Statistics; 1994. Advance Data from Vital and Health Statistics; No. 258.
27. U.S. Department of Agriculture, Agricultural Research Service. 1997. Data tables: Results from USDA’s 1994- 96 Continuing Survey of Food Intakes by Individuals and 1994-96 Diet and Health Knowledge Survey, ARS Food Surveys Research Group. December
1997. Available (under “Releases”): http://www.barc.usda.gov/bhnrc/foodsurvey/home.htm
28. National Research Council, Subcommittee on the Tenth Edition of the RDAs, Food and Nutrition Board, Commission on Life Sciences, Recommended Dietary Allowances. 10th ed. 1989. Washington DC: National Academy Press.
29. Murphy SP, Calloway DH. Nutrient intakes of women in NHANES II, emphasizing trace minerals, fiber, and phytate. J Am Diet Assoc. 1986; 86: 1366-1372.
30. Pollitt E. Iron deficiency and cognitive function. Annu Rev Nutr. 1993; 13: 521-537.
31. Abbott R. The effects of iron supplementation on cognitive function in infants and children. In: Sandstrom B, Walter P (eds). Role of Trace Elements for Health Promotion and Disease Prevention. Bibl Nutr Dieta. Basel, Karger, 1998; No. 54: 67-75.
32. Holst M-C. Developmental and behavioral effects of iron deficiency anemia in infants. Nutrition Today 1998; 33: 27-36.
33. Weinberg J, Dallman P, Levine S. Iron deficiency during early development in the rat: behavioral and physiological consequences. Pharmacol Biochem Behav. 1980; 12: 493-502.
34. Weinberg J, Brett L, Levine S, Dallman P. Long-term effects of iron deficiency on consummatory behavior in the rat. Pharmacol Biochem Behav. 1981; 14: 447-453.
35. Yehuda S, Youdim M, Mostofsky D. Brain iron-deficiency causes reduced learning capacity in rats. Pharmacol Biochem Behav. 1986; 25: 141-144.
36. Dallman PR. Biochemical basis for the manifestation of iron deficiency. Annu Rev Nutr. 1986; 6: 13-40.
37. Idjradinata P, Pollitt E. Reversal of developmental delays in iron-deficient anaemic infants treated with iron. Lancet 1993; 341: 1-4.
38. Walter T. Impact of iron deficiency on cognition in infancy and childhood. Europ J Clin Nutr. 1993; 47: 307-316.
39. Lozoff B, Brittenham GM, Wolf AW. Iron deficiency anaemia and iron therapy: effects on infant test performance. Pediatrics 1987; 79: 981-995.
40. Lozoff B, Jimenez E, Wolf AW. Long-term developmental outcome of infants with iron deficiency. N Engl J Med. 1991; 325: 687-694.
41. Lozoff B, Wolf AW, Jimenez E. Iron deficiency anemia and infant development: effects of extended oral iron therapy. J Pediatr. 1996; 129: 382-389.
42. Lozoff B, Wolf A, Mollen E, et al. Functional significance of early iron deficiency. Pediatr Res. 1997; 41: 15A.
43. Halberg L. Search for nutritional confounding factors in the relationship between iron deficiency and brain function. Am J Clin Nutr. 1989; 50: 598-606.
44. Pollitt E. Timing and vulnerability in research on malnutrition and cognition. Nutr Rev. 1996; 54: 49s- 55s.
45. Beard J. One person’s view of iron deficiency, development, and cognitive function. Am J Clin Nutr. 1995; 62: 709-710.
46. Strupp BJ, Levitsky DA. Enduring cognitive effects of early malnutrition: a theoretical reappraisal. J Nutr. 1995; 125: 2221s-2232s.
47. Corrigan N, Stewart M, Scott M, Fee F. Fragile X, iron, and neurodevelopmental screening in 8 year old children with mild to moderate learning difficulties. Arch Dis Child. 1997; 76: 264-267.
48. Soemantri AG. Preliminary findings on iron supplementation and learning achievement of rural Indonesian children. Am J Clin Nutr. 1989; 50: 698-702.
49. Soewondo S. The effect of iron deficiency and mental stimulation on Indonesian children’s cognitive performance and development. Kobe J Med Sci. 1995; 41: 1- 17.
50. Pollitt E, Hathirat P, Kotchabhakdi NJ, Missell L, Valyasevi A. Iron deficiency and educational achievement in Thailand. Am J Clin Nutr. 1989; 50: 687-697.
51. Seshadri S, Gopaldas T. Impact of iron supplementation on cognitive functions in preschool and school-aged children: the Indian experience. Am J Clin Nutr. 1989; 50: 675-686.
52. Bruner AB, Joffe A, Duggan AK, Casella JF, Brandt J. Randomised study of cognitive effects of iron supplementation in non-anaemic iron-deficient adolescent girls. Lancet 1996; 348: 992-996.
53. Tucker DM, Sandstead HH, Penland JG, Dawson SL, Milne DB. Iron status and brain function: serum ferritin levels associated with asymmetries of cortical electrophysiology and cognitive performance. Am J Clin Nutr. 1984; 39: 105-113.
54. Kretsch MJ, Fong AKH, Green MW, Johnson HL. Cognitive function, iron status, and hemoglobin concentration in obese dieting women. Europ J Clin Nutr. 1998; 52: 512-518.
55. Tucker DM, Penland JG, Sandstead HH, Milne DB, Heck DG, Klevay LM. Nutrition status and brain function in aging. Am J Clin Nutr. 1990; 52: 93-102.
56. Hallberg L. Search for nutritional confounding factors in the relationship between iron deficiency and brain function. Am J Clin Nutr. 1989; 50: 598-606.
57. Sandstead HH. Zinc deficiency: a public health problem? Am J Dis Child. 1996; 145: 853-859.
58. Prasad AS. Zinc: an overview. Nutrition 1995; 11: 93s- 99s.
59. Skinner JD, Carruth BR, Houck KS, et. al. Longitudinal study of nutrient and food intakes of infants aged 2 to 24 months. J Am Diet Assoc. 1997; 97: 496-504.
60. Sandstead HH, Smith JC Jr. Deliberations and evaluations of approaches, endpoints and paradigms for determining zinc dietary recommendations. J Nutr. 1996; 126: 2410s-2418s.
61. Caulfield LE, Zavaleta N, Shankar AH, Merialdi M. Potential contribution of maternal zinc supplementation during pregnancy to maternal and child survival. Am J Clin Nutr. 1998; 68: 499s-508s.
62. Frederickson C, Danscher G. Zinc-containing neurons in hippocampus and related CNS structure. Prog Brain Res. 1990; 83: 71-84.
63. Hesse G. Chronic zinc deficiency alters neuronal function of hippocampal mossy fibers. Science 1979; 205: 1005-1007.
64. Cuajungco MP, Lees GJ. Zinc metabolism in the brain: relevance to human neuro-degenerative disorders. Neurobiol Dis. 1997; 4: 137-169.
65. Golub MS, Keen CL, Gershwin ME, Hendrickx AG. Developmental zinc deficiency and behavior. J Nutr. 1995; 125: 2263s-2271s.
66. Halas ES, Eberhardt MJ, Diers MA, Sandstead SS. Learning and memory impairment in adult rats due to severe zinc deficiency during lactation. Physiol Behav. 1983; 30: 371-381.
67. Sandstead HH, Strobel DA, Logan GM, Marks EO, Jacob RA. Zinc deficiency in pregnant rhesus monkeys: effects on behavior of infants. Am J Clin Nutr. 1996; 31: 844-849.
68. Golub MS, Gershwin ME, Hurley LS, Hendrickx AG, Saito WY. Studies of marginal zinc deprivation in rhesus monkeys: infant behavior. Am J Clin Nutr. 1985; 42: 1229-1239.
69. Golub MS, Takeuchi PT, Keen CL, Gershwin ME, Hendrickx AG, Lonnerdal B. Modulation of behavioral performance of prepubertal monkeys by moderate dietary zinc deprivation. Am J Clin Nutr. 1994; 60: 238- 243.
70. Golub MS, Takeuchi PT, Keen CL, Hendrickx AG, Gershwin ME. Activity and attention in zinc-deprived adolescent monkeys. Am J Clin Nutr. 1996; 64: 908- 915.
71. Sazawal S, Bentley M, Black RE, Dhingra P, George S, Bhan MK. Effect of zinc supplementation on observed activity in preschool children in an urban slum population. Pediatrics 1996; 98: 1132-1137.
72. Bentley ME, Caulfield LE, Ram M., et. al. Zinc supplementation affects the activity patterns of rural Guatemalan infants. J Nutr. 1997; 127: 1333-1338.
73. Sandstead HH, Penland JG, Alcock NW, Dayal HH, Chen XC, Li JS, Zhao F, Yang JJ. Effects of repletion with zinc and other micronutrients on neuropsychologic performance and growth of Chinese children. Am J Clin Nutr. 1998; 68: 470s-475s.
74. Gibson RS, Vanderkooy PDS, MacDonald AC, Goldman A, Ryan BA, Berry M. A growth-limiting mild zinc deficiency syndrome in some Southern Ontario boys with low height percentiles. Am J Clin Nutr. 1989; 49: 1266-1273.
75. Cavan KR, Gibson RS, Grazioso CF, Isalque AM, Ruz M, Solomons N. Growth and body composition of periurban Guatemalan children in relation to zinc status: a longitudinal zinc intervention trial. Am J Clin Nutr. 1993; 57: 344-352.
76. Penland JG. Cognitive performance effects of low zinc (Zn) intakes in healthy adult men. FASEB J. 1991; 5: A938.
77. Darnell LS, Sandstead HH. Iron, zinc, and cognition of women. Am J Clin Nutr. 1991; 53: P-16.
78. Kirksey A, Rahmanifar A, Wachs TD, et al. Determinants of pregnancy outcome and newborn behavior of a semirural Egyptian population. Am J Clin Nutr. 1991; 54: 657-667.
79. Kirksey A, Wachs TD, Yunis F, et al. Relation of maternal zinc nutriture to pregnancy outcome and infant development in an Egyptian village. Am J Clin Nutr. 1994; 60: 782-92.
80. Burnet FM. A possible role of zinc in the pathology of dementia. Lancet 1981; 1: 186-188.
81. Tulley C, Snowdon D, Markesbery W. Serum zinc, senile plaques, and neurofibrillary tangles: findings from the Nun Study. Neuroreport 1995; 6: 2105-2108.
82. Licastro F, Davis LJ, Mocchegiani E, Fabris N. Impaired peripheral zinc metabolism in patients with senile dementia of probable Alzheimer’s Type as shown by low plasma concentrations of thymulin. Biol. Trace Element Research 1996; 51: 55-62.
83. Potocnik FCV, Van Rensburg SJ, Park C, Taljaard JJF, Emsley RA. Zinc and platelet membrane microviscosity in Alzheimer’s disease. S Afr Med J. 1997; 87: 1116- 1119.
84. Keen CL, Golub MS. Hematology parameters in female adolescent monkeys: effect of iron-zinc deficiency and a beef protein supplement. FASEB J. 1998; 12(4): A219 (1280).
85. Golub MS, Keen CL. Performance of an attention task by iron-zinc deficient adolescent monkeys and the influence of a beef protein supplement. FASEB J. 1998; 12(4): A236 (1377).
86. Gerrior S, Bente L. Nutrient content of the U.S. Food Supply, 1909-94. Home Economics Research Report No. 53. 1997. U.S. Department of Agriculture, Center for Nutrition Policy and Promotion.
87. National Live Stock and Meat Board. Eating in America Today. A Dietary Pattern and Intake Report Commissioned by the National Live Stock and Meat Board. Edition II. Chicago, IL: National Live Stock and Meat Board, 1994.
88. Subar AF, Krebs-Smith SM, Cook A, Kahle LL. Dietary sources of nutrients among US children, 1989-1991. Pediatrics 1998; 102: 913-923.
89. Subar AF, Krebs-Smith SM, Cook A, Kahle LL. Dietary sources of nutrients among US adults, 1989 to 1991. J Am Diet Assoc. 1998; 98: 537-547.
90. National Cattlemen’s Beef Association. Iron In Human Nutrition. 2nd ed. 1999. Chicago, IL: National Cattlemen’s Beef Association.
91. National Cattlemen’s Beef Association. Zinc In Human Nutrition. 2nd ed. 1997. Chicago, IL: National Cattlemen’s Beef Association.
92. Johnson JM, Walker PM. Zinc and iron utilization in young women consuming a beef-based diet. J Am Diet Assoc. 1992; 92: 1474-1478.
93. Zheng JJ, Mason JB, Rosenberg IH, et al. Measurement of zinc bioavailability from beef and a ready-to-eat highfiber breakfast cereal in humans: application of a whole-gut lavage technique. Am J Clin Nutr. 1993; 58: 902-907.
94. Jalla S, Steirn ME, Miller LV, Krebs NF. Comparison of zinc absorption from beef vs iron fortified rice cereal in breast-fed infants. FASEB J. 1998; 12(4): A346 (2010).
95. Westcott JL, Simon NB, Krebs NF. Growth, zinc and iron status, and development of exclusively breast-fed infants fed meat vs cereal as a first weaning food. FASEB J. 1998; 12(5): A 848 (4910).
96. U.S. Department of Agriculture, Agricultural Research Service. USDA Nutrient Database for Standard Reference, Release 12. Nutrient Data Laboratory, 1998. Home Page: http://www.nal.usda.gov/fnic/foodcomp.
97. U.S. Department of Agriculture, U.S. Department of Health and Human Services. Nutrition and Your Health: Dietary Guidelines for Americans. Fourth Edition. December 1995.
98. U.S. Department of Agriculture. The Food Guide Pyramid. Home and Garden Bulletin No. 252. 1992. Hyattsville, MD: USDA, Human Nutrition Information Service.
99. Center for Nutrition Policy and Promotion, US Department of Agriculture. The Healthy Eating Index. Washington DC: Office of Communications, 1995.
100. Coordenação-Geral da Política de Alimentação e Nutrição, Ministério da Saúde (http://dtr2004.saude.gov.br/nutricao/deficiencia_ferro.php).
101. http://www.bbc.co.uk/portuguese/ciencia/story/2004/01/040122_vitaminspc.shtml


