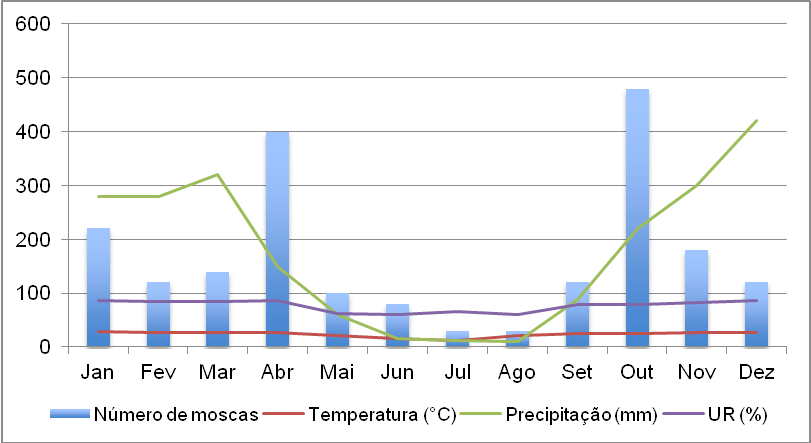
Mercados Futuros – 23/11/07
23 de novembro de 2007Com pouco boi no mercado, arroba segue firme
27 de novembro de 2007Febre Catarral Maligna
A febre catarral maligna é uma enfermidade altamente fatal que acomete bovinos e outros ruminantes (OIE, 2004). Tem a peculiaridade de não ser causada apenas por um vírus, mas por vários tipos de herpesvírus e por ocorrer esporadicamente e ser de difícil controle. A febre catarral maligna tem ampla distribuição mundial e uma de suas formas, associada à transmissão por gnus, está na lista de notificações obrigatórias da Organização Mundial de Saúde Animal (OIE, 2004).
A febre catarral maligna é uma enfermidade altamente fatal que acomete bovinos e outros ruminantes (OIE, 2004). Tem a peculiaridade de não ser causada apenas por um vírus, mas por vários tipos de herpesvírus e por ocorrer esporadicamente e ser de difícil controle. A febre catarral maligna tem ampla distribuição mundial e uma de suas formas, associada à transmissão por gnus, está na lista de notificações obrigatórias da Organização Mundial de Saúde Animal (OIE, 2004).
A enfermidade é reconhecida a mais de 200 anos, tendo sido descrita pela primeira vez por volta de 1700. A dificuldade de isolamento dos agentes etiológicos dificultou os trabalhos com a doença, mas avanços recentes no campo de biologia molecular permitiram melhorar o estudo da enfermidade, particularmente o diagnóstico.
Etiologia
Existe duas formas majoritárias da doença, cujos agentes pertencem à família Gammaherpesviridae, gênero Rhadinovírus. Uma delas é causada pelo vírus associado aos gnus, chamado alcelaphine herpesvírus 1 (AHV-1), ocorrendo principalmente em locais onde há grande concentração de cervídeos (Plowright et al., 1986). Vários ruminantes africanos são portadores do microrganismo. A segunda é associada a ovinos e causada pelo herpesvírus ovino 2 (OHV-2), cujas espécies portadores são ovinos e caprinos.
Tais vírus são bem adaptados às espécies portadoras, o que significa que não causam doenças clínicas nas mesmas. Nesses organismos, o agente se replica principalmente em períodos de stress e próximos ao parto. Os vírus são bastante frágeis, principalmente ao congelamento e são rapidamente inativados em ambientes inóspitos e quando expostos à luz.
As espécies suscetíveis e que apresentam os sinais clínicos são hospedeiros incomuns do vírus; nestas o microrganismo está pobremente adaptado e manifesta-se com maior virulência. Nesses casos, geralmente a doença é fatal e não ocorre a disseminação viral a partir dos indivíduos acometidos.
Epidemiologia
Os agentes da febre catarral maligna são transmitidos silenciosamente nas espécies adaptadas principalmente pelas secreções nasais e oculares. A epidemiologia do AHV-1 envolve transmissão tanto vertical quanto horizontal. O ápice da excreção viral ocorre aos quatro meses de idade (Mushi et al., 1981).
O entendimento da epidemiologia do OHV-2 ainda é controverso, devido às dificuldades para o isolamento do mesmo e entendimento de seus mecanismos de transmissão. A maioria dos cordeiros é infectada entre dois meses e dois meses e meio de vida. Trabalhos indicam que a remoção dos mesmos do contato com animais infectados antes dessa idade permite a criação de animais livres da infecção por OHV-2 (Ehllers et al., 1999). O ápice da excreção viral ocorre aos cinco meses em ovinos, mas ainda não se entende o papel dos caprinos na transmissão do vírus.
As principais fontes da infecção são as secreções nasais e oculares tanto em ovinos quanto em gnus. Observações a campo indicam que a transmissão ocorre mais eficientemente pelo contato íntimo, mas outros meios como água compartilhada também são facilitadores (Li et al., 2001). Ainda existe a possibilidade de transmissão por vetores mecânicos como insetos.
Enquanto nas espécies adaptadas a infecção é silenciosa e ocorre a replicação e transmissão do vírus, aquelas em que o agente está pobremente adaptado são as vítimas diretas da enfermidade, sofrendo os sinais clínicos, geralmente fatais. As espécies afetadas pertencem às subfamílias Bovinae e Cervidae. Bos taurus e Bos indicus são relativamente resistentes à infecção, porém búfalos e veados são bastante suscetíveis.
O período de incubação é bastante variável, havendo relatos de três a dez semanas (Lemos et al., 2005). Há descrição de períodos de incubação maiores, mas suspeita-se que os mesmos sejam casos de animais infectados subclinicamente nos quais ocorre recrudescência do vírus.
A enfermidade está distribuída amplamente pelo mundo. No Brasil, o primeiro relato foi em 1924 na Paraíba. Outros estados também registraram casos da doença como Rio Grande do Norte, Bahia, Sergipe, Piauí e Pernambuco (Macedo et al., 2007). As regiões Sul, Sudeste e Centro Oeste também notificaram a presença da doença, havendo o diagnóstico do OHV-2 por PCR no Rio Grande do Sul (Driemeier et al. 2002).
Estudos realizados no Rio Grande do Sul relataram que a enfermidade tende a ocorrer na forma esporádica (60% de incidência), em que apenas um ou até três animais são infectados. A forma de surtos epizoóticos tem 40% de incidência e afeta vários animais dentro do rebanho. A taxa de morbidade é baixa, variando de 2,5% a 20%, em contraste com a taxa de mortalidade cuja variação vai de 83% a 100%. O número de casos tende a aumentar no verão inexistindo predileção por idade ou sexo (Garmatz et al., 2004, Rech et al., 2004).
Sinais Clínicos
Os sinais clínicos descritos são bastante variados. Sintomas como depressão, diarréia, disenteria, coagulação intravascular disseminada e dispnéia podem ocorrer de 12 a 24 horas antes de morte súbita. Ocorre febre (temperatura entre 41 °C e 41,5 °C) e inapetência em casos menos agudos. Outros sintomas relatados são:
• Corrimento dos olhos e do nariz com tendência a se tornarem mucopurulentos;
• Focinho e narinas ficam incrustados com o muco ocasionando dispnéia, respiração com a boca aberta e salivação;
• Opacidade córnea bilateral;
• Hiperemia da mucosa oral com possibilidade de áreas multifocais ou difusas de necrose;
• A pele é freqüentemente ulcerada;
• Cobertura de cascos e chifre soltas ou inchadas;
• Diminuição da produção de leite;
• Linfonodos superficiais aumentados;
• Constipação;
• Sinais nervosos como incoordenação, movimentos de pedalagem, ataxia, letargia ou agressividade, convulsões e opistótono.
Entre as lesões post-mortem são encontradas:
• Inflamação e erosão das passagens nasais, mucosa gastrointestinal e bexiga;
• Pequenas artérias se tornam proeminentes e tortuosas no tecido sub-cutâneo, tórax e abdome;
• Exsudato catarral e erosões no trato respiratório;
• Poliartrite fibrosa.

Figura 1: Bovino apresentando rinite pseudo-membranosa, abundante corrimento nasal e conjuntiva ocular inflamada
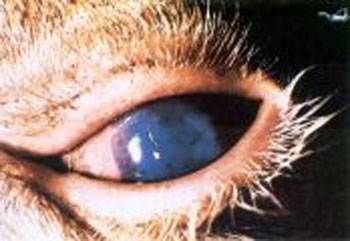
Figura 2: Bovino apresentando opacidade de córnea
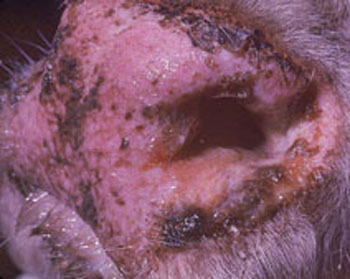
Figura 3: Bovino apresentando focinho hiperêmico, coberto por mucopurulento e pequenas erosões
Diagnóstico
O diagnóstico é realizado com base na sintomatologia, achados de necropsia e exames laboratoriais. Os principais espécimes clínicos para o diagnóstico são: baço, pulmão, linfonodos, glândulas adrenais e tireóide, os quais são para a realização de isolamento viral (ainda sem sucesso para o OHV-2) e teste de imunoperoxidase. Como o vírus se torna rapidamente inativo em animais mortos, as amostras devem ser colhidas imediatamente após a morte do animal.
Outro método usado atualmente é a PCR (Reação em Cadeia da Polimerase), capaz de detectar o DNA do vírus. A reação pode ser realizada a partir de amostras de sangue, tecidos frescos ou parafinados.
Os testes sorológicos são diferentes para AHV-1 e OHV-2. O primeiro pode ser detectado por vírus neutralização, imunoblotting, ELISA, imunofluorescência e imunocitoquímica. O OHV-2 é detectado em ovinos a partir de imunofluorescência ou imunoblotting, sendo o teste de imunofluorescência utilizado para o diagnóstico em bovinos. Deve-se saber, no entanto, que ruminantes raramente desenvolvem anticorpos neutralizantes para os vírus e qualquer tipo de anticorpo pode ser inexistente em casos mais agudos.
Controle
Não existem métodos de controle além da separação dos animais portadores dos animais susceptíveis. Em casos em que a convivência entre as espécies próximas é inevitável (como zoológicos), sugere-se testar os animais para a presença da infecção. Não existe vacina e nenhum tratamento consistente.
Referências bibliográficas:
Driemeier D., Brito M.F., Traveso S.D., Cattani C. & Cruz C.E.F. 2002. Outbreak of malignant catarrhal fever in browm brocket deer (Mazama gouazoubira) in Brazil. Vet. Rec. 151:271-272.
Ehlers, B., K. Borchers, C. Grund, K. Frolich, H. Ludwig, and H. J. Buhk. 1999. Detection of new DNA polymerase genes of known and potentially novel herpesviruses by PCR with degenerate and deoxyinosine-substituted primers. Virus Genes 18:211-220.
Garmatz S.L., Irigoyen L.F., Rech R.R., Brown C.C., Zhang J. & Barros C.S.L. 2004. Febre catarral maligna em bovinos no Rio Grande do Sul: Transmissão experimental para bovinos e caracterização do agente etiológico. Pesq. Vet. Bras. 24:93-106.
Lemos, R. A. A., Rech, R. R., Guimarães, E. B., Kadri, A., Dutra, I. S. 2005. Febre catarral maligna em bovinos do Mato Grosso do Sul e de São Paulo. Cienc. Rural., vol. 35, no. 4, pp. 932-934.
Li, H., Y. Hua, G. Snowder, and T. B. Crawford. 2001. Levels of ovine herpesvirus 2 DNA in nasal secretions and blood of sheep: implications for transmission. Vet. Microbiol. 79:301-310.
Macedo, J.T.S.A., Riet-Correa, F., Simões, S.V.D., Dantas, A.F.M., Nobre, V.M.T. 2007. Febre catarral maligna em bovinos na Paraíba. Pesq. Vet. Bras. vol. 27, no. 7, pp. 277-281.
Mushi, E. Z. and F. R. Rurangirwa. 1981. Malignant catarrhal fever virus shedding by infected cattle. Bulletin of Animal Health and Production in Africa 29:111-112.
Organização Mundial de Saúde Animal (OIE). Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, OIE World Organisation for Animal Health. Aujeszky’s Disease updated 2004/07/23. http://www.oie.int/eng/normes/mmanual/A_00041.htm
Plowright, W. 1986. Malignant catarrhal fever. Revue Scientifique et Technique, Office International des Epizooties 5:897-958.
Rech R.R., Schild A.L., Driemeier D., Garmatz S.L., Oliveira F., Riet-Correa F. & Barros C.S.L. 2005. Febre catarral maligna no Rio Grande do Sul: epidemiologia, sinais clínicos e patologia. Pesq. Vet. Bras. 25(2):97-105.